当院では乳癌手術は、日帰りまたは一泊入院で行います。
特に、高齢の方、持病や障害のある方、遠方からの方、市内でも一人暮らしの方、その他特別な理由、などの場合は、手術当日から翌日までの一泊入院を行なっております。最近は、一泊入院を希望される方が大半です。
乳癌の手術術式
1. 乳房温存か、乳房切除か。
乳癌の手術は、乳癌の辺縁から2 cmの距離をとって乳房を部分的に切除する乳房温存手術と、乳房を全て切除(全摘)する乳房切除術に大別されます。
乳房切除+腋窩郭清は、1890年代に遡る一世紀以上も前の「局所制御を重視したHalsted理論」に基づく術式で、一方、乳房温存手術+放射線療法は、1970年代の「乳癌を全身病とするFisher理論」に基づき発展して来ました。現在は、乳癌の初期段階(転移のないStage 0 および Stage I )は局所疾患で、次第に全身病へ移行すると考えられ、理論上、初期では手術による局所制御が有用で、全身病段階では手術は補助的役割となります。従って、理論的には、乳房切除がより有用なのはStage 0または1で、それ以上のStage の場合は、乳房を大きく切除しても治療成績の向上はなく、温存手術が適応となります。
本邦では、乳房再建の保険適用後、乳房切除が増加していますが、乳房切除が乳房温存+放射線療法より治療成績が優れるというエビデンスはなく、日本のガイドラインでは2000年頃の温存手術普及初期の論文を元に両者は同等であるとしています。しかし、温存手術が当たり前となった最近の2010年以降の多数の欧米論文では、乳房切除の治療成績が温存手術よりもむしろ不良である事が報告され、理論通りである事が実証されています。当院の治療成績でも、温存手術+放射線療法の方が、治療成績が統計学的にも良好です。
当院では、患者さんの希望があれば、腫瘍の大きさや皮膚浸潤の有無を問わず温存手術を行います。この場合、腫瘍径が2.5 - 3cmを超える場合、また、リンパ節転移がある場合、先に化学療法(抗癌剤)や内分泌療法を行い(術前療法といいます)、腫瘍を小さくしてから温存手術を行なう事を基本方針としています。乳頭浸潤がある場合は、温存手術に乳頭合併切除を追加します。
ただし、乳房全体を占めるような巨大な乳癌や、乳房の皮膚全体に広がるような炎症性乳癌のような場合は、温存は不可能です。 また、全身に転移があるような場合にも、化学療法や内分泌療法による術前療法を行い、その効果を評価してから手術が可能かどうかを考慮します
2. 乳房温存術
乳房の大きさに対して乳癌が小さい場合に適応となります。乳癌が大きいと、温存手術を行なっても、小さな乳房しか残せず、反対側の乳房とのバランスが崩れることがあります。一般的には乳癌の大きさが3 cm程度であれば温存手術が行われます。乳房の大きな場合は、3 cmよりも大きい乳癌でも温存手術が可能です。
最近では、3cmを超える大きさの乳癌では、抗癌剤や内分泌療法剤を手術前に投与して、乳癌を小さくしてから温存手術を行なうようになっています。これを術前療法といいます。
乳房温存手術のメリットは、人工物を用いずに乳房の膨らみを残せることです。一方、デメリットは、手術後に温存乳房に放射線を照射しない場合は、乳房内再発の可能性があることです。温存手術を行なった場合、3人に1人の割合で、乳房内に癌が遺残している可能性があると考えられています。そのため温存手術を行った場合は、再発予防の目的で手術後に放射線療法を行うのが原則です。通常、1回2分程度ですが、標準照射の場合、土日を除く毎日5−6週間、計25−30回、最近普及してきた寡分割照射では、毎日3−4週間、計16−20回、照射する必要があります。放射線療法を行わない場合の再発率は35-45%で、放射線療法を併用する事で、温存手術後の乳房内再発率は5-10%と低下すると報告されており(米国とオランダの報告)、我が国では2-5%と報告されています。従って、小さい腫瘍であっても、温存手術を行った場合は、必ず放射線治療を併用する必要があります。当院の経験では、stage 0や1であっても、温存手術をして放射線治療をしていない場合に再発が多く見られます。
3. 乳房切除術
乳房の大きさに対して病変部分が大きかったり、癌が多発性であるもの、また重い合併症があったり、高齢など、術後に放射線治療が困難と思われる場合で、温存手術が適応とならない場合には乳房切除となります。患者が温存手術を希望しない場合にも適応となります。また、温存手術を行っても、切除断端から広い範囲で癌細胞が検出された場合には、あらためて乳房切除を行うこともあります。
メリットは、原則として放射線治療をしなくて済むことです。しかし、腫瘍が大きい場合や多発性の場合、また悪性度の高い癌の場合は、乳房切除をしても局所再発する事がしばしばあり、再発リスクが必ずしも低くなる訳ではなく、放射線療法や抗癌剤を併用する事が必要となります。特に、術後の病理検査で、リンパ節転移陽性の場合や、皮膚浸潤陽性の場合は、乳房切除を行なっても放射線療法を行う必要があります。
デメリットは、乳房の膨らみがなくなるため、精神的なダメージや、生活への影響が大きいことです。 最近、乳房再建に保険が適用されることになりました。乳房切除の乳房再建は、切除と同時に行なう方法と、しばらくしてから行う方法があります。従来の乳房再建は、術後数年(通常3年以上)経過し、再発がないことを確認して行うのが普通でした。最近は、切除後すぐに行う施設が増加しています。しかし、長期の治療成績は未だ不明です。従来はリンパ節転移がないことや周囲への広がりや浸潤がない事が再建の条件でした(転移・再発の可能性が高いため)。従って、乳房再建に保険が適用された事により、再建の適応範囲がいきなり拡大された訳です。前述の様に、再建後は放射線治療に障害が出たりしますので、放射線治療の必要のないリンパ節転移や周囲浸潤のない進行していない症例が再建の対象となります。そうであれば、そのような症例は、乳房切除の必要がなく、温存手術が可能ということになり、現在の乳房再建の適応は理論的に矛盾しています。
豊胸術後の乳癌発症については、現在のところ、シリコンバッグによる豊胸術の場合は、乳癌発症とは関連が無いとされています。しかし、豊胸術後の乳癌例は進行例の割合がかなり多く、治療成績は不良です。
また、バッグによる豊胸術が普及したのは最近20年のことですので、症例が多くなっている最近の豊胸術後の10年後が注目されます。当院では2023年までに、シリコンバッグによる豊胸術後の乳癌発症例を5例経験しています。
注:人工乳房(インプラント)による悪性リンパ腫及び扁平上皮癌の発生
2019年、シリコンなどのゲル充填人工乳房(breast implant)の埋め込み患者に悪性リンパ腫(anaplastic large cell lymphoma:ALCL) が発症したという報告が世界に衝撃を与えました。ゲル充填人工乳房の使用にはリスクの説明を行い、フォローアップを継続するようにと、厚生労働省は2019年6月7日に「ゲル充填人工乳房の『使用上の注意』の改訂について」を通知し、注意喚起を行いました。2022年の時点で全世界で約1200例、日本で4例が発症し、37例が死亡と報告されています。
フランスでは、ALCLが発症したことをうけて、人工乳房インプラントの使用停止に、続いて、カナダ、シンガポールでも使用停止になりました。日本では、業者による自主回収と使用の自粛が行われました。その後、表面がザラザラのタイプの人工乳房インプラントが原因であるとして、表面がツルツルのインプラントの使用許可がなされましたが、安全性については確認されていません。
当時の米国のFDA(食品医薬品局)の医療死亡事故登録報告によれば、表面がツルツルのタイプのインプラントでもALCLが発症し、さらに別のタイプのリンパ腫による死亡例も報告されていました。
さらに2022年に衝撃的な報告が為されました。B Iによる豊胸手術を受けた患者さんに扁平上皮癌(SCC)が発症したとの報告がなされました。2022までに16例の発症報告があります。また、SCCは、あらゆる種類のインプラントに発症し、インプラント周囲のカプセルに発症するようです。さらにALCL以外のリンパ腫の発症も報告されました。SCCは食道、肺、皮膚、子宮頚部、口腔などに発症し、乳癌では特殊型の化生癌に分類され、発生頻度は稀ですが、悪性度が高いのが特徴です。インプラント関連SCCは現状では、乳腺由来ではないようですが、遠隔転移を含めた高い浸潤性を示すとされています。
ALCLの発症までは、平均8年ですが、術後2年で発症した症例もあります。
人工乳房の周囲に液体が貯留することが、兆候の一つで、その他、疼痛、腫瘤、腫脹、潰瘍などがあります。このような変化が見られたら、人工乳房が破損していることもあり、人工乳房を摘出して、リンパ腫が発生していないかを検査をする必要があります。
特に、人工乳房の手術をして10年以上経過している場合は要注意と言えます。
異物による慢性刺激が発症の原因と思われますが、人工乳房埋め込みによる副作用としては、リンパ腫, SCC以外にも、乳癌などの癌の発生、自己免疫疾患の発症、神経障害などが報告されています。
4. 術前療法
最近では、大きな乳癌(2.5 - 3cm以上)や、腫瘍径が小さくてもリンパ節転移のある場合は、乳房切除を行うのではなく、術前に化学療法(抗癌剤)や内分泌療法による術前療法を行って、腫瘍を縮小させてから温存手術をする事があります。
1つは、腫瘍を小さくして乳房温存手術が可能になるようにする目的と、もう1つは、癌が活発に増殖している大きな腫瘍では、手術操作により転移が促進する可能性があります。このため、乳癌の活性を、術前に抗癌剤や内分泌療法剤で抑制して、手術操作により転移が促進することを予防する目的もあります。
トリプルネガティブ乳癌の場合は、小さくても(径1cm以上であれば)術前療法を行う方が、治療成績が良くなることが明らかになってきています。術前療法は施設により、使用する薬剤や治療期間も異なり、画像上、腫瘍が完全に消失(完全奏効)するまで術前療法を継続して手術をする施設から(半年から1年かかることもあります)、ある程度温存が楽にできるサイズにまで小さくなれば手術を行なう施設まで(1-3ヶ月程度の事が多い)様々です。ただ、いたずらに完全奏効を求めて長期投与しても効果がない場合や、逆に途中から腫瘍が増大することもあり、治療効果と治療期間の見極めが肝要となります。
5. リンパ節をどうするか。
乳癌は、腋窩(脇の下)のリンパ節への転移がしばしばみられます(10 - 20%)。このため、腋窩リンパ節の再発を防ぐために腋窩リンパ節をまとめて切除する腋窩リンパ節郭清が必要となる場合があります。
したがって、乳癌の手術では温存手術、全摘手術いずれの場合にも、リンパ節郭清を行うかどうかを決める必要があります。リンパ節転移が予想される程度によって、取り除く範囲が決まってきます。
従来は、腋窩リンパ節に転移があってもなくても、腋窩リンパ節郭清を行うのが当たり前でした。しかし、術後に後遺症として上肢が腫れたり(リンパ浮腫)、だるくなったり、動かしにくくなったりすることがしばしばあります。リンパ節に転移がある場合、郭清はどうしても必要ですが、リンパ節転移のない場合は、後遺症が残るだけの場合もあります。
最近では、センチネルリンパ節生検を手術中に行って、腋窩のリンパ節郭清が必要かどうかを決定します。センチネルとは「見張り」を意味します。センチネルリンパ節は、乳癌が最初に転移するリンパ節で、ここに転移がなければその先のリンパ節にも転移がないと考えられます。乳癌と乳頭部に放射性同位元素や色素を注射し、色素に染まったり、放射性同位元素が集まったりしたリンパ節をセンチネルリンパ節として摘出し、癌の転移の有無を調べるのがセンチネルリンパ節生検です。当院では、蛍光色素法によるセンチネルリンパ節生検を行っております。
したがって、術前の検査で、明らかにリンパ節転移が認められた場合は、腋窩リンパ節郭清を行います。一方、腋窩リンパ節転移が明らかでない場合は、センチネルリンパ節生検を行い、センチネルリンパ節に転移がある場合には、腋窩リンパ節郭清を行いますが、センチネルリンパ節に転移がなければ、郭清を行ないません。
センチネルリンパ節の転移の有無については、従来は、摘出したリンパ節を凍結させて病理診断を行う方法(術中迅速病理診断)が一般的でしたが、ホルマリン固定ではないため、病理診断が難しく、誤診率が20-40%にものぼり、その診断精度が問題でした。また、診断までに1 - 2時間もかかっていました。
最近では、摘出リンパ節の癌遺伝子を調べて判定するOSNA法が行われるようになっています。診断の精度は95%以上とされ、また時間も30 分程度で済みます。当院は他施設に先駆けて京都で最初にOSNA法を導入した施設です。
リンパ節転移は浸潤癌の場合に問題となります。非浸潤癌が転移する事は理屈の上ではあり得ないことになっているため、リンパ節郭清は通常行いません(ただし、実際には転移報告が数多くなされています)。しかも、術前の非浸潤癌という診断は腫瘍の一部の生検による診断であるため、必ずしも100%正確ではありません。このため、術後の腫瘍全体の病理検査で一部に浸潤癌が存在し、最終的に浸潤癌と診断が訂正される事がしばしばあります。したがって、広範囲な非浸潤癌や腫瘤を形成している非浸潤癌では、一部に浸潤癌が存在する可能性を考慮して、センチネルリンパ節生検を行う必要があります。最近の海外の論文では、術前に非浸潤癌と診断された患者さんの約5%に腋窩リンパ節転移があり、術後診断で非浸潤癌であった場合でも1-2%の転移があった事が報告されています。当院の経験では、5cm以上の非浸潤癌では、リンパ節転移が多く見られています。
乳癌の手術後の予後は臨床病期(stage)が最もよく反映します。
生存率は、大きく2種類に分類されます。Stage分類は、大きく分類すると2種類あります。
1つは全生存率(OS)で、手術日から一定期間後の生存者の割合を示し、死亡原因は区別しません。癌死亡のみを対象とする場合は癌関連死亡率として表示することがあります。
もう1つは再発生存率(RFS)で、癌の再発を認めない状態で生存している割合を言います。
両者を合わせて、治療成績を評価する必要があります。
全生存率は癌以外の死亡によるものも、統計に含めます。癌治療の影響による可能性があるためとされています。このため、癌治療の成績を正確に反映しないことがあります、一方、無再発生存率は、定期的に検査を行なっている施設では、無症状の転移・再発初期を早くから検出するため、再発率が高いように見え、逆に症状が出てから検査をする施設では転移・再発が進行してから再発の診断がされるため、再発率が低く見える傾向があります。両者を比較して評価しないと治療成績の本当の姿が見えません。(施設の姿勢を判別するにはどうすればよいか考えてみてください)
一般的には、OSのほうが、RFSよりも良好です。
追跡率も重要です。大学での術後追跡調査の経験では、通院が途絶えたり、連絡の取れなくなった患者さんは亡くなっていることが多いのですが、統計処理上は生存打ち切りとなり、追跡中止時は生存中となり、生存率が高くなります。本来は、追跡調査をする必要がありますが、以前と異なり個人情報保護のため、行政に問い合わせることが出来なくなり、手間と費用が相当かかります。ある大病院の調査では、5年以後の予後不明率が40%以上に達し、カルテの通院記録から算出した生存率と比較して、追跡調査による生存率は10-20%ぐらい低下したと報告されています。乳癌学会の生存率報告は全国の大病院が主体ですが、5年追跡率は50%以下にすぎません。大病院の場合は、遠方からの患者が多いため、追跡率が悪く、一部の追跡調査部門がある施設以外は、追跡調査をしている施設は多くないのが現状です。このため、実際の生存率は公表値よりも低いと推定されます。真面目に追跡調査をすれば、生存率が低くなる(治療成績が悪く見える)ため、気が進まないのも事実です。
当院の場合、京都府内の患者さんが多く連絡が取りやすいこと、患者さんのネットワークやご家族からの情報提供も多いため、追跡率は術後10年で、毎年の解析時に90%を超えています。最近は、高齢のため施設に入所する方が多く、追跡が難しくなっています。乳癌の場合は10年以後の再発もみられるため、10年以後の追跡調査も重要になりつつありと考えます。
いずれにしても、最近は手術術式や放射線療法も進歩し、さらに新しい治療薬(抗癌剤、内分泌療法、分子標的療法など)も導入されているため、進行例での治療成績が徐々に向上しています。
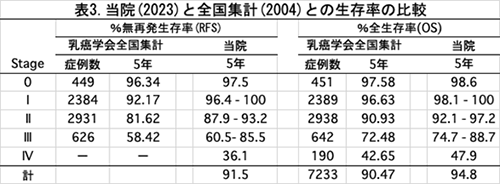
日本の施設の一般的な根治術後のstage別5年生存率は、全国乳がん患者登録調査報告 5年後予後解析結果 2004年次症例(乳癌学会ホームページ)(追跡率48.9%)によると、全生存率(overall survival rate;OS) が、全例, 90.47%; Stage 0期, 97.58%; I期, 96.63%; II期, 90.93%; III期, 72.48%; IV期, 42.65%、一方、無再発生存率(Relapses-free survival, RFS)は、全例, ―; Stage 0期, 97.57%; I期, 93.82%; II期, 85.03%; III期, 63.08%; IV期, ―、とされています。
一方、当院の治療成績は、術後1年以上経過している2023年12月末までの原発手術症例は2104例で、温存手術例は1865例、乳房切除例は239例です。温存率は88.6%で、最近の10年間では85-90%です。また、温存手術例の最大腫瘍径は11cmです。
2023年12月末までの当院手術例の治療成績を表1にまとめました。
2024年より15年生存率も表示しています。
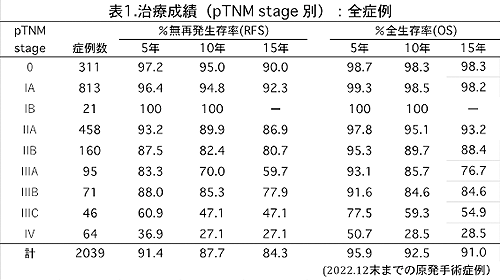
最近のT N M分類の改訂によりStage I が I Aと I B に細分化されました。
このため、Stage 0, I, IIの症例数と治療成績に若干の変動があります。
5・10・15年無再発生存率(RFS)(IVは無増悪生存率)は、全体で91.5・87.9・85.0%で、pTNM stage別では、0期 97.5・95.8・92.0%; IA期 96.4・95.0・93.0%; IB期 100・100・100%; IIA期 93.2・89.7・86.9%; IIB期 87.9・82.4・80.8%; IIIA期 83.3・70.5・61.1%; IIIB期 85.5・82.7・77.4%; IIIC期 60.5・47.7・47.7%; IV期 36.1・25.8・25.8%、でした。
また、5・10・15年全生存率(OS)は、全体で94.8%・90.6・87.6%で、pTNM stage別では、0期 98.6・96.4・95.1%;IA期 98.1・96.6・94.3%; IB期 100・100・100 %; IIA期 97.2・92.7・89.9%; IIB期 93.3・88.1・82.1%; IIIA期 92.1・84.8・77.3%; IIIB期 88.7・80.6・80.6%; IIIC期 74.7・57.1・51.7%; IV期 47.9・26.9・26.9%、でした。当院手術例の死亡原因ですが、2023.12までに把握出来ているのは180例で、乳癌関連死亡は137例、その他が43例です。その他の死亡原因でもっとも多いのは乳癌以外の悪性手術で、14例あり、うち膵癌が5例ともっとも多くなっています。ついで老衰が10例、心臓発作9例となっています。
15年生存率を見ますと、術後10年を過ぎても生存率が低下している事が明らかです。乳癌は術後10年以後の再発(晩期再発)も多いことを示す結果と言えます。いつまで再発予防の術後補助療法を継続すべきかを改めて考えさせられます。
乳房温存手術と乳房切除術の治療成績を比較して、表2にまとめました。温存手術例は1801例、乳房切除例は238例です。
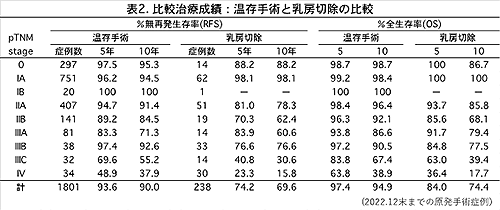 一般的には、乳房切除の方が温存手術よりも治療成績が同等または良好と考えられています。しかし、2010年以降、温存と乳切の生存率を比較した海外論文が11件あり、その内1件が同等、残りの10件は全て温存の方が乳切よりも生存率が良好と報告されており、国際的にも温存手術+放射線療法の方が、乳房切除よりも治療成績が良好とする報告が多いことが分かります。当院の治療成績でも温存手術+放射線療法の治療成績の方が良好でStage 0とIAを除いて、すべてのStageで、10年全生存率が5〜25%良好です。
一般的には、乳房切除の方が温存手術よりも治療成績が同等または良好と考えられています。しかし、2010年以降、温存と乳切の生存率を比較した海外論文が11件あり、その内1件が同等、残りの10件は全て温存の方が乳切よりも生存率が良好と報告されており、国際的にも温存手術+放射線療法の方が、乳房切除よりも治療成績が良好とする報告が多いことが分かります。当院の治療成績でも温存手術+放射線療法の治療成績の方が良好でStage 0とIAを除いて、すべてのStageで、10年全生存率が5〜25%良好です。
この理由として、(1) 温存手術+放射線治療は最近の患者さんが多く、術後治療も新しい薬剤を使用していること: (2) 乳房切除例は、温存手術が不可能な大きさの症例が含まれている事などが考えられます。このため単純に比較することはできませんが、当院では、stage 0とI では両者は同等(当院の温存例では、放射線治療を拒否された症例や民間療法を受けられた症例が再発死亡されています)で、Stage II 以上では、stage IV でも温存手術+放射線治療の方が生存率は良好です。 当院の症例の多変量解析(両者の背景:腫瘍径、stage、年令、ホルモン受容体発現、HER2発現などを補正して生存期間への影響を調べる解析)でも、温存手術は放射線療法を併用した場合、乳房切除よりも再発および死亡リスクを低下させる統計学的有意変数でした。
したがって、腫瘍径の大きなStage III や遠隔転移のあるStage IV であっても、術前および術後の治療をきちんと行うことで、温存手術+放射線治療により乳房切除より良好な結果が得られることがわかります。
最後に、全国乳がん患者登録調査報告 5年後予後解析結果 2004年次症例(乳癌学会ホームページ)(追跡率48.9%)と当院の治療成績を比較した表3を示します。すべてのステージで当院の生存率が、全国集計よりも良好です。Stageが進行するほど、差が大きくなっています。