乳房温存療法を行った場合、心配なのは癌の取り残しや、
切除した場所以外にも画像診断では見つからなかった癌細胞が潜んでいることです。
それらが再発や転移の原因となるからです。手術後の切除した癌組織を顕微鏡で調べると、
温存療法を受けた患者さんの20 - 30%に癌細胞が残っていることが明らかになっています。
そこで、温存療法を行った場合、温存した乳房に放射線をあてることで、乳房局所の再発率が2 - 3%程度に抑えられます。
一方、全身に転移しているかもしれない乳癌細胞を殺したり、増殖しないように抑える全身療法が必要です。この全身療法は薬物療法により行なわれます。
薬物療法には、化学療法(抗癌剤)と内分泌療法(女性ホルモンを抑制する療法)があり、最近ではこれらに加えて分子標的療法が行なわれるようになりました。この3者を組み合わせて術後の治療を行いますが、どのような治療法を選択するかは、個々の患者さんで異なります。
通常は、リンパ節転移の有無、ホルモン感受性の有無、組織学的悪性度、HER-2蛋白発現、年齢などを組み合わせたリスク分類に基づく治療ガイドラインに準拠して行うのが一般的です。
当院では、国際ガイドラインを参考にして、独自の経験と治療成績に基づいた術後療法を行なっており、特に臨床病期がstage 1と2Aの患者さんには副作用の少ない療法を行なっております。 リスク分類による治療ガイドラインにはいろいろありますが、よく用いられる St.Gallan expert consensus meetingの推奨指針をわかりやすいように日本語になおして表に まとめましたので、参考にしてください。
前述のように、温存手術後の乳房照射は温存乳房内の局所再発を予防するために原則として行ないます。一般的には、乳房に手術のダメージが残っている術直後は避け、3-6か月以内(日本では5ヶ月以内)に開始されます。当院では通常、術後1-2ヶ月から開始しています。通常、土日を除く月〜金の週5日間毎日照射をします。1回2分程度の照射時間です。従来は、5-6週間、25-30回、線量にして1回あたり2Gy(グレイ)、計50-60Gyを照射するのが一般的でした。最近では、照射回数を減らしても治療成績が変わらないという臨床試験の結果に基づいて、1回線量を少し多くして2.66Gyを16-20回、計42.56Gy照射する寡分割照射が標準になりつつあります。
乳房温存後に行う放射線療法は、乳房に照射するため、全身への影響はあまりありません。
ですから、脱毛もありませんし、食欲が低下することもほとんどありません。しかし、体型や癌の位置によっては、肺の一部に放射線があたるため、放射線肺炎を起こすことがまれにあります(1-2%の頻度といわれています)。また、皮膚の弱い人では、海水浴の後のように皮膚炎がおこる人もありますが、軟膏治療により通常2週間くらいで治ります。
1970年代に行われたアメリカの臨床試験の結果では、温存手術後に放射線照射をしなかったグループの再発率が35%であったのに対し、放射線照射を受けたグループでは10%であったと報告されています。
その後のオランダの臨床試験では、温存手術後に放射線照射をしなかったグループの再発率が45%であったのに対し、放射線照射を受けたグループでは5%であったと報告されています。
日本では、放射線照射をしない場合の再発率は明らかではありませんが、放射線照射をした場合の局所再発率は2-5%程度と報告されています。
腋窩リンパ節に転移がみられる場合、腋窩照射を追加することがあります。さらに腋窩の奥の方にまで転移がみられる場合は、鎖骨上窩照射を追加することもあります。これらの放射線照射により局所再発率が約1/3(1/2-1/5)に低下します。
最近の欧米の報告では、腋窩にリンパ節転移があっても、腋窩郭清をせずに放射線治療を優先させる方が、治療成績が良好である事が判明しており、本邦でも同様の方針をとる施設が20−30%あることが判明しています。
乳房切除をした場合でも、腋窩リンパ節に転移がある場合、胸壁と腋窩照射をすることで再発率が低下します。また、皮膚浸潤のある乳癌では、皮下のリンパ管に沿って癌が広がっている事が多く、乳房切除を行っても局所再発予防の為に放射線照射が必要です。
術後に薬物療法、特に化学療法と放射線照射のどちらを先行させるのか、また同時に行う方がよいのかについての結論は出ていません。しかし、リンパ節転移がある場合のように、潜在的にどこかに遠隔転移が存在すると考えられるような場合には、化学療法を先行させるべきとの考え方があります。
また、局所再発、リンパ節再発、骨転移に対しても放射線照射は、局所制御、疼痛管理の点で有用ですが、生存率を向上させる効果はないとされています。
前述のように転移・再発予防のための全身療法は薬物療法により行なわれ、薬物療法には、化学療法(抗癌剤)、内分泌療法(女性ホルモンを抑制する療法)、分子標的療法があり、これら3者を組み合わせて治療を行います。
乳癌は化学療法が比較的奏効する癌です。
現在主として使用されている薬剤は、注射薬としては、
アントラサイクリン系は、ドキソルビシン(アドリアシン)とエピルビシン(ファルモルビシン)が、
タキサン系はパクリタキセル (タキソール)、ドセタキセル (タキソテール)、およびアブラキサンが、
代謝拮抗剤では、5-FU(5-フルオロウラシル)やゲムシタビン(ジェムザール)が、
アルキル化剤はシクロホスファミド(エンドキサン)、マイトマイシンが、
ビンカアルカロイド系では、ビノレルビン (ナベルビン)が用いられます、
その他、抗腫瘍性アルカロイドのイリノテカン(トポテシン)や海綿由来有機物質エリブリン(ハラヴェン)、白金製剤のカルボプラチン (パラプラチン)も使用されます。
以上のうち、アントラサイクリン系薬剤とタキサン系薬剤、さらに5-FUやシクロホスファミドが1次治療の標準薬として用いられます。多くの抗癌剤はいずれも脱毛という副作用がありますが、 ゲムシタビン (ジェムザール)とビノレルビン (ナベルビン)は脱毛が少ないという特徴があります。また、HER2陽性乳癌に用いられるカドサイラ (トラスツズマブエムタンシン)という抗HER2抗体と抗癌剤の複合剤も脱毛がないのが特徴です。

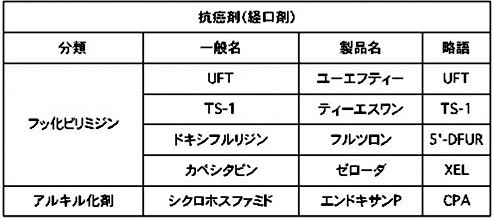
経口薬(飲み薬)としては、
UFT(ユーエフティー)、TS-1(ティーエスワン)、ドキシフルリジン(フルツロン)、カペシタビン(ゼローダ)、シクロフォスファミド(エンドキサンP)などの薬剤があります。
化学療法、特に注射薬には、脱毛、全身倦怠感、末梢神経障害、口内炎などに加えて、骨髄抑制、肝障害、間質性肺炎などの、時として致命的になるような副作用があります。
一方、経口薬も、手足症候群、口内炎、下痢、末梢神経障害、味覚・嗅覚障害、膀胱炎などの副作用がみられます。
いずれにしても、定期的に血液検査を行ないながら、注意深く治療を行う必要があります。
抗癌剤の副作用のうち、嘔気、嘔吐、全身倦怠などは、優れた予防薬が開発されたため、ほとんど問題にはなりません。
また、骨髄抑制による白血球減少も白血球増多因子などの開発により問題となる事はほとんどありません。ただ、血小板減少には有効な対処法がないため、投与を中断して回復を待つしかありません。
脱毛も未だ有効な治療法や予防法がないのが現状です。しかし、治療が終了すれば、通常2−3ヶ月で元通りに回復します。当院では、脱毛の予防として、頭部を冷やして頭髪への血流を減少させて、頭髪への抗癌剤の影響を減らすダンクールキャップなどを用いています。
末梢神経障害も有効な治療法や予防法がないのが現状です。タキサン系やアントラサイクリン系薬剤の投与でしばしばみられますが、投与の際に手足を冷やしたり、手足をきついゴム手袋やソックスを装着して血流を抑制し、抗癌剤が指先に流れにくくする方法が有効との報告もあり、当院でも採用しています。一般的には、ビタミンB12、B6などを投与しますが、漢方薬の真武湯が有効なこともあります。
b1.内分泌療法の薬剤
乳癌の60-70%が、女性ホルモンの影響を受けて増殖するLuminal(ルミナール)型です。 そのため、女性ホルモンの作用を抑制したり、女性ホルモンの分泌を抑制すれば、 乳癌の増殖を抑えることができます。このような治療法が内分泌療法です。
この内分泌療法は女性ホルモンの影響を受ける乳癌、 すなわち乳癌細胞に女性ホルモン受容体(女性ホルモンと結合するタンパク)がある場合に有効ですので、女性ホルモン受容体の有無を調べることが大切です。
基本的には2種類の女性ホルモン、エストロジェンとプロゲステロンの受容体(それぞれ、ER、PgRと呼びます)について検査を行ないます。
本邦で使用される内分泌療法剤を表にまとめました。

内分泌療法の基本薬剤は、タモキシフェン(ノルバデックス)というエストロジェンとその受容体の作用を抑制する薬です(SERM)。 タモキシフェンは閉経前と閉経後の両者に用いられ、術後補助療法としては早期症例やリンパ節転移(-)例には5年間、リンパ節転移(+)などの高リスク例には5年以後も継続投与することが有用です。最近の欧米の報告では、リンパ節転移がなくても、7 - 8年、さらには10年の継続投与が有用である事が判明しており、本邦でも今後は長期投与が常識となると思われます。
タモキシフェンの最大の問題点は、副作用として子宮内膜の増殖を来す事で、このため、長期投与により子宮内膜癌、子宮体癌が発症することがあります。同じ系統の薬剤としては、トレミフェン(フェアストン)がありますが、術後の補助療法としてよりも、転移・再発症例に使用する事が多い薬剤です。
これに対し、閉経前のホルモン受容体(+)の早期症例には、脳下垂体に作用して卵巣からの女性ホルモンの分泌を抑制するLH-RHアナログという薬のゴセレリン(ゾラデックス)やリュープロレリン(リュープリン)の投与が推奨されています。また、ゾラデックスやリュープリンとタモキシフェンの併用も、再発例やstage が進行しているケースでよく行われます。
さらに、閉経後のホルモン受容体(+)の早期症例には、副腎から分泌される男性ホルモンを女性ホルモンに変えるアロマターゼという酵素を阻害する アロマターゼ阻害剤を投与します。アナストロゾール(アリミデックス)、エキセメスタン(アロマシン)、レトロゾール(フェマーラ)と3種類あり、閉経後乳癌においてはタモキシフェンよりも推奨されています。
アロマターゼ阻害剤もタモキシフェン同様に5年以上投与する事が望ましいとされていますが、アロマターゼ阻害剤は、
骨塩を低下させる副作用があり、骨粗鬆症を引き起こすことがあるため、65才以上では、骨塩を測定しながら服用する必要があります。
また、タモキシフェンを2-5年投与し、その後はアロマターゼ阻害剤を投与する交代療法も推奨されています。
その他、プロゲステロン製剤のメドロキシプロゲステロン(ヒスロンH、プロゲストン)も用いられます。また、メピチオスタン(チオデロン)もエストロジェンとその受容体の作用を抑制する薬剤ですが、男性ホルモン様作用が強いため、近年はあまり用いられていません。両者とも、他のホルモン療法剤の効果がなくなってきた時などに使用します。
フルベストラント(フェソロデックス)という注射薬は比較的新しい薬剤です。癌細胞のエストロジェン受容体(ER)を減少させる薬剤(SERD)ですが、閉経を問わず、乳癌で他のホルモン療法剤の効果がなくなってきた場合や、進行例や再発例の治療に用いられます。また、後述する分子標的療法剤のCDK4/6阻害剤であるイブランスやベージニオと併用して用いられます。
内分泌療法はホルモン受容体陽性乳癌に対する最も重要な治療法ですが、長期間の治療中に効果がなくなってくることがあります。これを耐性出現と言います。多くの場合は薬剤を変更する事で治療の継続が可能ですが、薬剤の変更を行っても効果がないことも多々あります。そのような場合、フルベストラント (フェソロデックス)と併用する事で耐性を克服できることがあります。
さらに、これらの方法でも全く効果がなくなって来た場合、古くからある方法ですが、男性ホルモンを投与したりすることもあります。また、逆に女性ホルモンであるエストロジェンの投与が奏効することがありますが、一般的には行われておりません。
内分泌療法は化学療法に比べて、致命的な副作用はないのですが、女性ホルモンを抑制するため、 更年期症状とよく似た症状が出ます。
ほてり、のぼせ、いらいら、発汗、震え、体温調節がうまく行かず暑さや寒さに敏感になり、抑鬱症状や、不安神経症のような症状が出ることもあります。 また、関節痛が出る人もあります。さらに、しみ・そばかすが増えたり、膣乾燥症や掻痒症に悩む人もいますし、高齢者では骨粗鬆症も問題となります。
また、アロマターゼ阻害剤は、閉経前の人に使用すると逆効果になるため、閉経後か閉経前かの診断も重要です。50歳を過ぎて月経がなくても、ホルモン値を測定すると閉経前の状態である事がよくあります。この場合は、閉経期としてタモキシフェンを使用することになります。ホルモン値が高い場合はリュープリンやゾラデックスを使用することもあります。
タモキシフェンを投与すると、通常はホルモン値が低下しますが、稀に閉経前〜閉経期の女性で卵巣刺激作用を示し、ホルモン値がかなり上昇することがあります。この場合もゾラデックスやリュープリンに切り替える必要があります。
b2.内分泌療法耐性に対する分子標的療法剤:mTOR阻害剤、C D K4/6阻害剤
内分泌療法耐性に対する分子標的療法剤としては、mTOR阻害剤のアフィニトール(エべロリムス)と、CDK4/6阻害剤のイブランス(パルボシクリブ)、ベージニオ(アベマシクリブ)があります。いずれもHER2(-)のER(+)乳癌に対し投与されます。
mTOR阻害剤
アフィニトール(エベロリムス)は、癌細胞の分裂、血管新生および細胞代謝の調節において重要な役割を果たすmTORというタンパクを標的とするmTOR阻害剤です。mTORは、内分泌療法の耐性機序の1つであるER-HER2 cross-talk経路における増殖因子シグナルの中心です。
エストロジェン非依存性のER活性化はHER familyの活性化を誘導し、下流のPI3K/AKT/mTOR経路を過剰活性化する(cross-talk経路)と考えられており、内分泌療法(通常はエキセメスタン:アロマシン)にアフィニトールを併用することで、内分泌療法への抵抗性を克服することが期待できるとされています。非常に高価である事と副作用の口内炎、免疫抑制、間質性肺炎が問題です。
C D K4/6阻害剤
ERやHER familyからの増殖刺激を受けると、サイクリンDが合成され、CDK4/6と結合して複合体を形成し、細胞周期のG1チェックポイントを制御するが、イブランス(パルボシクリブ)とベージニオ(アベマシクリブ)は、このCDK4/6を阻害することで、細胞周期がG1からS期へ移行するのを阻害して細胞増殖を抑制する。通常は、進行再発例に対しアロマターゼ阻害剤やフルベストラントとの併用で使用されます。
当院の経験では、イブランスは、自覚的副作用はほとんどないのですが、骨髄抑制が強く、標準量を投与できるケースがほとんどなく、減量や休薬しながら投与しています。ただ、減量投与の場合でも著効例が見られており、投与法に工夫が必要です。また、間質性肺炎も副作用としてあります。
ベージニオは、副作用としては下痢が問題ですが、薬物療法で対処できることが多く、イブランスと異なり骨髄抑制は少ないようです。しかし、間質性肺炎による死亡例が報告されており、慎重に投与する必要があります。当院の経験では、症状としての副作用は少ないのですが、やはり間質性肺炎と下痢が問題です。
イブランスもベージニオも、自覚症としての副作用は少ないのですが、抗癌剤投与を長期に行なっていたケースでは、骨髄抑制が強く出たり、間質性肺炎が出やすいようで、投与初期は副作用の慎重なチェックが必要です。
当院では、化学療法でCR(完全奏効)になった場合に、イブランスやベージニオに切り替えて、C Rを維持するために使用する事が多いのですが、抗癌剤の効果がなくなってきた場合に、イブランスやベージニオに切り替えて、肝転移が消失したり、癌性胸水が消失した例もあります。ただ、効果が出るのに抗癌剤よりも少し時間がかかるように思えます。
b3.ルミナール(Luminal)型乳癌の晩期再発
ER(+)のルミナール型乳癌は、術後10年はおろか20年を経過しても転移再発することがあり、内分泌療法を長期投与する主たる理由の1つです。ルミナール型乳癌の晩期再発の原因としては色々な可能性があります。
ER(+)のルミナール型乳癌の治療は内分泌療法が主体である。内分泌療法は、抗癌剤や放射線のように癌細胞を直接死滅させるのではなく、ERや増殖因子受容体と結合し、増殖シグナルを阻害する治療法である。したがって、癌細胞の増殖を抑制し、アポトーシスによる緩やかな細胞死(programmed death)を誘導するが、必ずしも癌細胞全体の完全な死滅に繋がるわけではない。
すなわち、肉眼的に癌組織は消失(検知不能レベルに縮小)しても、完全に消滅しているわけではなく、一部の癌細胞は、増殖が抑制されてはいるが、顕微鏡レベルで遺残している可能性がある。その場合、治療終了により、増殖シグナルの抑制がなくなると、遺残した癌細胞がゆっくりと再増殖すると考えられる。これが、ルミナール型乳癌の晩期再発の一因と考えられています。
また、内分泌療法に耐性となった顕微鏡的遺残細胞が再増殖してくる可能性も考えられます。
一方、ER(+)の判定基準は、一般にER(+)細胞が10%以上を陽性と判定することが多い。すなわち、ER陽性といっても、ER(+)細胞の割合は10〜100%までかなり幅があります。ER(+)の割合が少ない場合、抗癌剤を併用しないと内分泌療法単独で長期にわたる治療を行なってもER(-)の細胞がかなり遺残する可能性があります。単純に考えれば、ER(+)が10%の場合、内分泌療法単独ではER(-)の90%の細胞が遺残する可能性があります。
さらに、原発巣と転移巣でsubtypeが異なる場合があり、原発巣がER(+)であっても転移巣でER(-)のことが少なからずあります(intra-tumor heterogeneity: 腫瘍内多様性または不均一性)。院長の大学勤務時の研究(業績、発表論文15)では、乳癌の約 24% において、原発巣と転移リンパ節の間で ER 発現は一致していませんでした。この場合も、抗癌剤の投与がなければ、内分泌療法単独を長期間行っても、顕微鏡的転移巣からゆっくりと再発してくる可能性があります。
したがって、ルミナール型であっても、手術で完全に切除される可能性が高いstage 0〜Iの局所疾患の段階は別としても、全身疾患へと移行しているstage II以上の場合、また、stageが低くてもER(+)細胞の割合が少ない場合や、また細胞分裂の頻度が高い(増殖速度が速い)Ki67指数の高い場合は、原発巣切除+内分泌療法だけでは不十分であり、顕微鏡的遺残細胞全体の死滅を引き起こしうる放射線治療や化学療法の併用が不可欠と考えます。
ハーセプチン、タイケルブ、パージェタ、カドサイラは、HER-2というタンパク質が強陽性の乳癌に投与される抗HER2薬です。HER2蛋白は、HER2蛋白のみならず、HER1やHER3タンパクと結合して二量体となることで活性化します。このうちHER2-HER3の結合体が最も活性が高いとされます。
HER2陽性乳癌に使用される抗HER2療法剤を表にまとめました。

ハーセプチン(トラスツズマブ)は、HER2の第4ドメインを標的とするヒト化モノクローナル抗体で、HER2の活性化を阻害し、抗体依存性細胞傷害活性を介して効果を発揮すると考えられています。当初は進行再発例に限って投与していましたが、現在は術後補助療法の1つとしてHER2強陽性のHigh risk例にも投与されます。重要な副作用としては、心毒性があげられます。通常は3週に1回計18回(1年)の投与が標準です。同等の効果を示すとされるバイオシミラーとよばれる後発品が発売されています。
パージェタ(ペルツズマブ)は、ハーセプチンと同様にHER2を標的としたヒト化モノクローナル抗体の注射薬です。ハーセプチンとは異なるHER2の部位(第2ドメイン)を標的としているため、ハーセプチンの作用を補完すると考えられています。パージェタは、HER2がHER3と二量体を形成するのを阻害する事で、細胞の増殖シグナルを遮断すると考えられています。従って、ハーセプチンと併用されます。
当初は、ハーセプチンに対する耐性が出現して来た場合に併用されましたが、術前療法や術後補助療法での使用が可能となり、併用が標準となっています。重要な副作用としては、ハーセプチンと同様、心毒性があげられます。実際の現場では、下痢が問題ですが、下痢止めで十分に対処できます。また、ハーセプチン・パージェタの皮下注射薬であるフェスゴ配合皮下注も発売されました。
タイケルブ(ラパチニブ)は、チロシンキナーザ阻害剤で、HER2とHER1の細胞内チロシンキナーゼを阻害する経口薬剤で、手術不能または再発例に対して用いられます。重要な副作用としては、下痢や皮膚障害があげられます。通常はゼローダという経口抗癌剤やアロマターゼ阻害剤と併用して用いられます。ゼローダも下痢の副作用が強く、両者の併用による下痢の程度はかなり重度となります。ハーセプチンは抗体のため、分子量が大きく、血液脳関門(blood-brain barrier)を通過しないため、脳転移には無効とされていますが、タイケルブは分子量が小さく、血液脳関門を通過する可能性が高く、HER2陽性乳癌の脳転移例へ効果が期待されます。
注:脳転移では、血液脳関門が破綻しているため、ハーセプチンが脳転移巣へ到達するという報告もあります。
カドサイラは、ハーセプチンと抗癌剤であるチューブリン重合阻害剤エムタンシンを結合させた抗体-抗癌剤複合体で、通称トラスツズマブ・エムタンシン(T-DM1)と呼ばれます。抗体と抗癌剤の組み合わせによる相乗効果が期待され、一般的には、ハーセプチンとパージェタの耐性が出現した場合に用いられますが、術後補助療法で使用される場合もあります。副作用はハーセプチンと同様ですが、強力な抗癌剤との複合物にも関わらず、脱毛が少ないという特徴があります。効果は確かにありますが、血小板減少が重要な副作用で、回復に時間が掛かることがあります。
エンハーツは、カドサイラ 同様に、トラスツズマブに抗癌剤デルクステカンを結合させた抗体-
抗癌剤複合体です。HER2陽性の再発、手術不能例に適応があります。カドサイラ と異なるのは、HER2低発現例にも適応が認められた事です。HER2低発現例に投与可能であるということは、トリプルネガティブ乳癌にも適応があるということになります。今後の臨床投与後のデータの集積が待たれるところです。問題は副作用で、間質性肺炎が問題になります。その他の副作用はハーセプチン、カドサイラ と同様ですが、カドサイラ と異なり、脱毛はそれなりにあります。抗癌剤のデルクステカンは抗癌剤イリノテカンの誘導体ですので、本来はかなり副作用の強い抗癌剤です。
c2. 血管新生阻害剤
アバスチン(ベバシズマブ)はVEGF(血管内皮細胞増殖因子)を標的とするヒト化モノクローナル抗体の注射薬で、腫瘍の新生血管の造成を阻害することで作用を発揮します。通常は抗癌剤のパクリタキセル (タキソール)と併用して投与されます。
重要な副作用としては、出血(肺、消化管、脳など)、高血圧、血栓症、心毒性などがあげられますが、パクリタキセルとの併用しか保険適用がないため、パクリタキセルの神経毒性などの副作用の方が強く出現します。高血圧による腎障害も問題とされています。
基本的に、再発・手術不能乳癌に対して用いられ、特に、トリプルネガティブ(TN)乳癌の再発転移例によく使用されます。
当院の経験では、ハーセプチン耐性が出現したHER2陽性転移再発乳癌にハーセプチン+パージェタとの併用で高い効果を示すことがあります。当院の経験では、TN乳癌に対してもパクリタキセルのみとの併用よりも、パクリタキセル+アバスチンに加えて他の抗癌剤も追加併用した方が、効果がより高いようです。
c3. ポリアデノシン5’二リン酸リボースポリメラーゼ(PARP)阻害剤: リムパーザ(オラパリブ)
PARPはDNAの1本鎖切断を修復する酵素で、正常細胞では、DNAが損傷した場合、PARPなどの修復酵素がDNAを修復します。PARP阻害剤でPARPによる修復を阻害しても、修復機能を有するBRCA1/BRCA2蛋白が修復するため、正常細胞は生存可能です。したがって、BRCAの変異のある乳癌では、BRCAタンパクが無いため、PARPによるDNA修復阻害が不可逆的となります。このため、PARP阻害剤はBRCA変異(+)の乳癌で効果を示すことが期待されます。
PARP阻害剤のリムパーザの保険適用は、タキサン系、アントラサイクリン系抗癌剤の投与を受けたことのある、BRCA変異(+)でHER2(-)の手術不能または再発乳癌です。BRCA変異の検査をした上で、リムパーザの投与の適応かどうかを判定します。BRCA変異(+)乳癌はトリプルネガティブ(TN)乳癌に多いとされていますが、実際には、ER(+)HER2(-)乳癌にも同程度存在することがわかっています。したがって、内分泌療法耐性乳癌やTN乳癌での応用が期待されます。当院の経験では、副作用も少なく、効果も高いようです。
注)内分泌療法耐性に対する分子標的療法剤 内分泌療法耐性に対する分子標的療法剤のmTOR阻害剤アフィニトール(エべロリムス)と、CDK4/6阻害剤イブランス(パルボシクリブ)、ベージニオ(アベマシクリブ)については、内分泌療法を参照
乳癌の転移で最も頻度が高いのは骨転移です。癌細胞はそれ自身では骨を破壊することができず、破骨細胞を活性化する事で骨転移病巣を形成します。そこで、破骨細胞を抑制する薬剤が骨転移の治療に用いられます。現在、ビスフォスホネート製剤と抗RANKLモノクローナル抗体の2種類の系統の薬剤が用いられています。
ビスフォスホネート製剤としては、パミドロン酸(アレディア)とゾレドロン酸(ゾメタ)があり、両者ともに点滴静注で投与され、抗癌剤やホルモン療法剤との併用で用いられます。
抗RANKLモノクローナル抗体としては、デスノマブ(ランマーク)がH24年より保険適用となりました。皮下注射で投与されます。
いずれの薬剤も骨転移による病的骨折、疼痛、脊髄圧迫などの骨関連症状の進行を防止し、遅らせることを目的に使用します。最も重要な副作用は低カルシウム血症で、生命に関わることがあります。また、顎骨壊死も重要な副作用です。
免疫チェックポイント阻害剤
従来の癌免疫療法は、癌を攻撃するサイトカインを投与したり、細胞障害性T細胞やN K細胞の活性を高める療法、活性化リンパ球療法などが行われてきました。しかし、必ずしも効果があったとは言い難いのが実態でした。
近年、これらとは全く異なる発想から開発されたのが免疫チェックポイント阻害剤です。腫瘍免疫の中心はT細胞リンパ球ですが、このT細胞表面、特に活性化されたT細胞には、さまざまな分子が発現します。これらの分子と癌細胞や抗原提示細胞などに発現する分子が結合することによりT細胞の免疫応答が活性化されたり、抑制されたりします。後者の抑制的に働く場合を「免疫チェックポイント」と呼びます。
免疫チェックポイント分子として、癌治療に関係するのはCTLA-4とPD-1ですが、乳癌治療に関係するのはPD-1です。
PD-1(programmed-cell death-1/CD279)は活性化T細胞に発現する免疫チェックポイント分子で、そのリガンド(結合物質):としてPD-L1、PD-L2が知られています。どちらも癌細胞や抗原提示細胞で発現し、PD-1と結合することで、T細胞の活性化が阻害され、抗腫瘍免疫が抑制されます。癌細胞は、自らに発現したPD-L1やPD-L2をT細胞のPD-1に結合させることで、T細胞を抑制し、免疫逃避を誘導していると考えられます。したがって、このPD-1をブロックすることで、T細胞の抑制が阻害される可能性があります。
現在、用いられている乳癌に対する免疫チェックポイント阻害剤は、このPD-1をブロックする抗体です。本庄教授の開発したオプジーボは乳癌に対する保険適用はありませんが、キイトルーダ(ペムブロリズマブ)とテセントリク(アテゾリズマブ)が適用が認められています。どちらも、トリプルネガティブ乳癌に対して適用され、臨床試験において抗癌剤との併用で高い効果が認められています。併用する抗癌剤としては、パクリタキセル、アブラキサン、カルボプラチンなどがあります。
使用する場合、癌組織におけるPD-L1の発現を検査する必要があり、発現陽性例での効果が高いとされています。当初は、手術不能または再発乳癌が対象でしたが、術前、術後療法にも応用されています。
両者とも従来の抗癌剤と同じ骨髄抑制などの副作用に加え、特に間質性肺炎、大腸炎、肝障害、甲状腺機能障害、脳神経障害など独特な副作用があり、慎重な投与後の観察が必要です。このため、現在、投与可能な施設が限定されています。
免疫チェックポイント阻害薬の投与を受けた場合、稀に腫瘍が急速に増大する現象(Hyper Progressive Disease:HPD)が報告されています。治療により、元の腫瘍サイズの2倍以上になった場合をHPDとしていますが、治療により病状が進行・悪化し、急速な転帰をとることもあり、十分な注意観察が必要です。